El pez cebra es objeto de investigación en centenares de laboratorios y por millares de investigadores en todo el mundo. Se considera un instrumento clave en la investigación biomédica y medioambiental porque comparte un remoto origen común con los humanos (hace 400 millones de años), porque su mantenimiento es relativamente económico y porque puede ayudar a reducir el uso de mamíferos en la experimentación. La joven promesa de la investigación que era en 1980 ha conseguido una posición privilegiada al lado de organismos con mayor tradición como la mosca del vinagre y el ratón. La publicación de la secuencia de su genoma ha llegado con cierto retraso, pues sólo recientemente (2008) se ha obtenido una versión casi completa.
Acuarios en el laboratorio
En un tanque de 20 litros se pueden criar un centenar de peces. Una hembra puede poner 300 huevos en un día, semana o cada quince días dependiendo de si las condiciones en el laboratorio son más o menos favorables. Los embriones miden menos de 1 mm lo que permite colocar gran cantidad en una sola placa (dispositivo para la observación de embriones) para seguir su desarrollo. El desarrollo de los embriones ocurre en 24 horas, pudiendo reconocerse la mayor parte de los órganos. A los cinco días las larvas son móviles, han terminado de consumir la mayor parte del vitelo y se inicia la alimentación exógena. Esta característica es importante porque bajo la actual legislación sobre experimentación animal un pez se considera animal a partir de que comienza la alimentación exógena. Se ha observado que en el pez cebra eso sucede a partir de los cinco días del desarrollo. Por lo tanto, el uso de embriones de pez cebra hasta ese momento -es el período en el que se realizan la mayoría de los ensayos- se considera un método alternativo y no experimentación con animales.
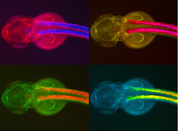
Peces fluorescentes y transgénicos
Los embriones transparentes del pez cebra también se pueden utilizar para estudiar la morfología y la fisiología de determinados grupos de células mediante sondas y anticuerpos fluorescentes a partir de técnicas de tinción inmunohistoquímica e hibridaciones in situ. Una técnica más sofisticada es insertar en los embriones construcciones transgénicas que llevan una proteína fluorescente (Proteína Verde Fluorescente, PVF o GPF en sus siglas inglesas, extraída de la medusa Aequorea victoria) unida a un secuencia específica de ADN (promotor) del tejido que se desea observar (muscular, tiroides, línea lateral). Las construcciones PVF-promotor se denominan transgenes y los animales que las portan son animales transgénicos. El promotor es un trozo de ADN que actúa como un interruptor, activando o desactivando la acción de un gen. Estas construcciones o transgenes permiten ver las diferencias entre peces normales y peces en los que la función de un gen ha sido alterada.
Fármacos y tóxicos
El pez cebra como material de experimentación permite la identificación sistemática de nuevos fármacos y la observación y análisis de los efectos de fármacos y productos tóxicos en todo el organismo. Por esta razón, en los campos de la farmacología, la toxicología y la ecotoxicología, esta especie se plantea como un paso intermedio eficaz en el proceso de desarrollo de fármacos y como un sistema muy fino para detectar los efectos toxicológicos tanto de los productos de nueva síntesis como de los contaminantes emergentes del medio ambiente.
Identificación de nuevos fármacos
La reducida dimensión de los embriones del pez cebra permite agilizar el análisis de una extensa colección de moléculas candidatas a ser un nuevo fármaco y su identificación, una de las fases más arduas del proceso de desarrollo de fármacos. Además, estos análisis se realizan en un sistema vivo y permiten ver los efectos en todo el organismo. Esto permite por una parte superar las limitaciones de las pruebas celulares que no siempre reúnen las condiciones “in vivo” y por otra, evitan tener que recurrir al uso de mamíferos en fases tempranas del desarrollo de fármacos, al tiempo que resultan más económicos.
Productos tóxicos en el ambiente
El pez cebra se utiliza para analizar los efectos subletales de los contaminantes emergentes, cuyos efectos pueden ser potencialmente graves para la supervivencia de las especies o para la salud humana. Los fibratos, por ejemplo, son fármacos reguladores lipídicos que tras su consumo por el ser humano llegan a las aguas superficiales. Al no ser eliminados eficientemente por las plantas depuradoras, se ha empezado a considerar los efectos que pueden tenen los seres vivos. De hecho, experimentos hechos en el laboratorio muestran que en medios ricos en clofibratos se induce un síndrome de mala absorción de lípidos en embriones del pez cebra. Por otro lado, este modelo de laboratorio también se utiliza para estudiar aquellos contaminantes que destruyen específicamente los neuromastos de la línea lateral de las larvas. Esta estructura es esencial para el equilibrio y para la detección de presas y predadores por parte del pez cebra. Los neuromastos pueden ser detectados, in vivo o post-mortem, con marcadores selectivos de dicha estructura. También se puede marcar las neuronas motoras para ver el efecto que produce su exposición a compuestos neurotóxicos como la cafeína o la nicotina.
Regeneración de tejidos
A diferencia de los mamíferos, el pez cebra tiene la capacidad de regenerar algunos tejidos como el nervioso, el tejido del corazón, de la retina o del oído. Investigar los mecanismos que actúan en el proceso regenerativo despliega nuevas oportunidades para la reparación de tejidos lesionados en humanos. Hay que tener en cuenta cómo se ha mantenido la actividad regenerativa en la línea evolutiva de los vertebrados y establecer, mediante análisis genómicos, los genes implicados en ese proceso. La idea es que se podría actuar sobre les genes ortólogos en mamíferos para “reactivar” la actividad regenerativa perdida.
Sistema modelo para estudios de función y regulación génica
El pez cebra es excelente para el desarrollo de estudios genómicos de relevancia para la salud humana. Puesto que todos los vertebrados evolucionan de manera similar durante las primeras fases del desarrollo embrionario, este modelo permite estudiar la función de genes implicados en procesos que tienen lugar durante el desarrollo temprano de todos los vertebrados, entre ellos los humanos. También, se ha revelado como un potente sistema para llevar a cabo estudios de regulación génica “in vivo”. Las secuencias de regulación cis (control a nivel del mismo cromosoma) controlan dónde y cómo los genes se transcriben y pueden activar (activadores) o reprimir (silenciadores) la expresión génica. Generando peces transgénicos en los que estas secuencias controlan la expresión de la Proteína Verde Fluorescente, PVF, se puede visualizar la actividad de dichas secuencias reguladoras “in vivo”.
La memoria de los peces
El pez cebra es un animal social, es decir, que acostumbra a estar en presencia de individuos de la misma especie. Por ello, puede ser útil para investigar la genética del comportamiento. Además, tiene un comportamiento diurno lo que permite hacer las medidas en el tiempo natural de actividad. En el adulto se están investigando las bases moleculares del comportamiento de búsqueda de recompensa como punto de partida para las adicciones y cuestiones relacionadas con el aprendizaje y la memoria. A nivel de larva, la captura de presas sirve para estudiar comportamientos simples como la locomoción y la visión.